China International Examination Medical and IVD Exhibition 2024
新冠病毒变异毒株分类
2019 年底新冠疫情爆发, 2020 年 1 月下旬起蔓延至全国。随后数月,新冠疫情席卷全球。随着时间 的推移,所有病毒的基因组都会发生突变,作为 RNA 病毒,新冠病毒的基因组更易发生突变,有一 些突变可能会影响病毒的传播力、致病性、疫苗效果等,根据病毒的危险程度,世界卫生组织(WHO) 将新冠突变体分为关切变异株(Variants of Concern ,VOC)和关注变异株(specific Variants of Interest , VOI),其中,关切变异株对全球疫情影响最大。
目前世卫组织将 5 种新冠病毒变种列为关切变异株,分别是:最早在英国发现的阿尔法(Alpha )、 南非发现的贝塔(Beta)、巴西发现的伽马(Gamma)、印度发现的德尔塔(Delta)以及南非发现的 奥密克戎(Omicron);此外,有两种新冠病毒变种被列为的关注变异株,分别是:最早在秘鲁发现 的拉姆达(Lambda)和哥伦比亚发现的缪毒株(Mu)。
1.1 Omicron 变异毒株成为全球新冠主要流行毒株
全球新冠病毒基因组抽样的数据显示,从 2019 年 12 月 14 日至 2022 年 3 月 19 日,Delta 和 Omicron 的 变异毒株数量目前明显高于其他变异毒株。
根据 Nextstrain 的数据, Alpha 是初期变异毒株的主要传播者,随后,具有更强传播力的 Delta 毒株在 印度快速爆发,2021 年 11 月 26 日,世界卫生组织将南非发现的 B.1.1.529 变异株定义为第五种“关切 变异株”,取名希腊字母 Omicron(奥密克戎)变异株,目前,在全球新冠感染者中,Omicron 已经成 为传播能力超过其他四种 VOC 变异毒株的最强变异株,截止到 2022 年 3 月 21 日,在美国、英国、 德国、法国、加拿大、西班牙、澳大利亚等国家,Omicron 的流行占比均已超过 98%。
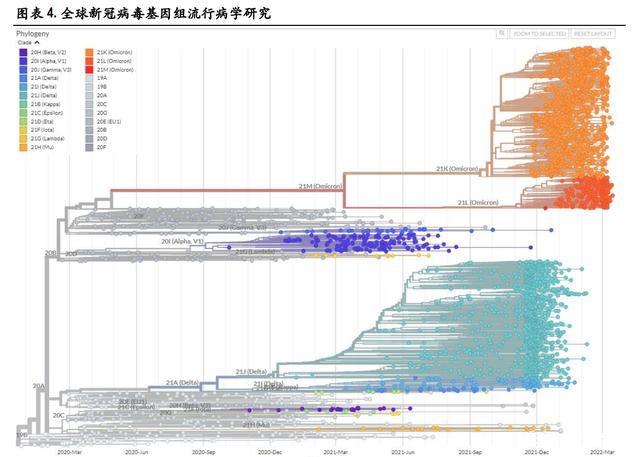
值得一提的是,2022 年 3 月 8 日,包含 Delta 和 Omicron 突变特征的 Deltacron 突变体被首次证实,目前 暂时还没有证据显示这种重组毒株是否会在传染性和严重程度上有所改变,更多详细的研究仍在进 行中,我们也将持续关注。
1.2 现有研究表明:Omicron 传染力强,致病性弱
Omicron 毒株之所以备受关注,主要是因为它携有大量基因突变,Omicron 同时具有前 4 个 VOC 变异株 Alpha(阿尔法)、Beta(贝塔)、Gamma(伽玛)和 Delta(德尔塔)刺突蛋白的重要氨 基酸突变位点,这些突变可能会导致病毒的传染性和逃避疫苗免疫的能力增强。(报告来源:未来智库)
1、技术原理分析
新型冠状病毒肺炎(新冠肺炎,COVID-19)为新发急性呼吸道传染病, 已成为全球性重大公共卫生事 件。鉴于目前香港疫情反弹,国内不同城市仍有不同程度的疫情定点爆发,而新冠病毒持续变异, 传播力强、致病性强、发病进程快,因此快速有效的病毒检测对病情的防控显得尤为重要。国内外 科研机构和企业也陆续开发了一系列检测方法来满足 SARS-CoV-2 病毒检测的应急需求。目前获得我 国国家药品监督管理局批准上市的 SARS-CoV-2 病毒检测试剂盒有 83个,其中,核酸检测试剂盒 34 个, 抗体检测试剂盒 30 个,抗原检测试剂盒 19 个 。新冠病毒的诊断市场主要包括以荧光 PCR 的方法为 主流的分子诊断和以免疫层析法、化学发光免疫分析法为主流的免疫诊断两大细分领域。
1. 分子诊断
分子诊断的检测对象通常是新冠病毒核酸的特异性基因序列片段。当前国内广泛应用的新型冠状病 毒分子检测方法是实时荧光 PCR 核酸检测,其特点是高特异性、高灵敏度和感染前期可检测,是全 球公认的确诊新冠肺炎感染的金标准。该技术在普通 PCR 基础上加入荧光染料或荧光标记探针来实 现对进程的实时检测。目前,新冠病毒核酸检测试剂一般检测基因及核衣壳蛋白(nucleocapsid protein, N)基因双靶标,也有单靶标(ORF1ab)和三靶标(ORF1ab、N 和 E)检测试剂。除此之外,其他分 子诊断方法包括数字 PCR、等温扩增技术、基于 CRISPR/Cas9 的诊断方法、生物传感器等方法正在开 发和验证中。
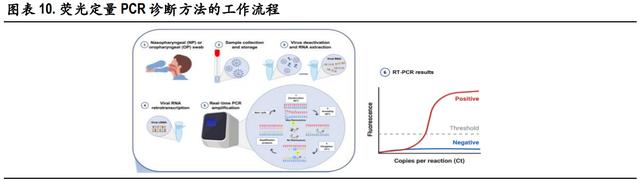
基于荧光定量 PCR 的分子诊断方法的工作流程包括:1) 通过鼻咽或口咽拭子收集疑似新冠肺炎患 者的样本;2) 保存和处理拭子,以保持病毒 RNA 的完整性;3)对 SARS-CoV-2 热灭活和提取 RNA; 4)病毒 RNA 逆转录为双链 cDNA;5)PCR 扩增和实时荧光信号检测;6)对检测结果进行分析。
总体来看,分子诊断技术目前呈现出其与生物学与物理学以及其他学科相结合的趋势,如荧光 PCR 技术是生物学和物理学的结合技术,生物芯片是生物学、物理学和计算机科学的结合技术。目前市 场上已出现测序技术、生物芯片技术、生物传感技术、表面等离子体谐振技术、微阵列芯片技术等 新型检测技术,未来分子诊断行业将结合多种技术,不仅可以实时快速检测,而且可以同时检测多 个基因并实现基因分型检测,大幅度提高了疾病诊断水平。
2. 免疫诊断
根据检测对象不同,免疫诊断可分为抗原检测和抗体检测。抗体检测比较主流的方法是免疫侧流层 析法和化学发光法。与核酸检测相比,快速抗原和快速抗体检测的特点是检测时间更快,约为 15-30 分钟,成本更低,操作更简单,不需要训练有素的人员。
抗原检测,针对 SARS-CoV-2 的 N 蛋白和 S 蛋白等病毒固有组分,利用针对新冠抗原蛋白制备的特异 性单克隆抗体,对呼吸道、消化道等样本中的新冠抗原蛋白进行直接检测。主要使用的方法是免疫 侧流层析法(也可以用酶免和化学发光等方法获得更高的灵敏度和准确性)。
抗体检测,针对患者血液中的新冠特异性抗体(IgM /IgG)进行检测,其最大特点是检测耗时短、准 确性高,但只有在患者感染 1 周后才会产生可被检测的抗体。因此,抗体检测存在检测窗口期,只 能做既往感染判别,不适用于复阳患者和再次感染患者的检测等问题,主要作为辅助诊断的手段。 国内主要使用的方法是免疫侧流层析法和化学发光法。
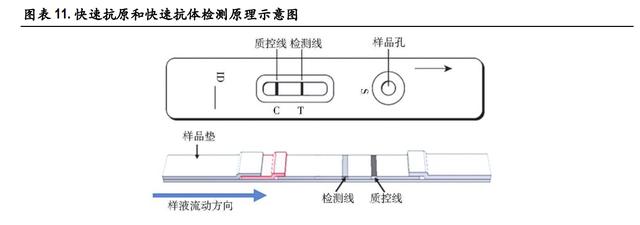
2.1 免疫侧流层析法
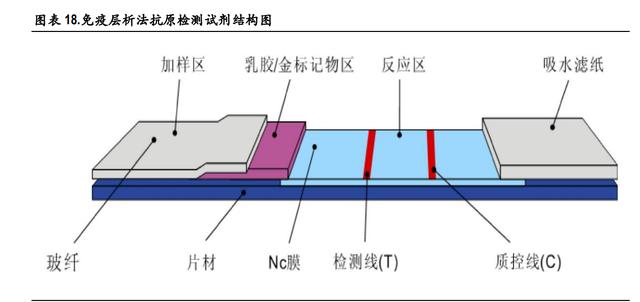
免疫侧流层析法是新冠抗原检测主要依赖的技术手段,利用筛选得到的新冠特异性抗体对新冠的抗 原进行有效的捕获和识别。相比于 ELISA、化学发光法,免疫侧流层析法速度最更快、最为简便。以 胶体金侧流免疫层析法为例,其检测原理:特异性的抗原或抗体被事先固定在载体上,通 常是大孔径的微孔滤膜如 NC 膜。纸纤维所形成的毛细力拉动待测样本从试纸的一端流向另外一端。 C 线为质控线,正常情况下缓冲液会带动标记了胶体金的抗体向前流动,到达该处时将与抗-金标抗 体结合,呈现阳性结果即代表该产品使用正常。T 线为检测线,若样本为阳性,向前流动时新冠抗 原的 N 蛋白或 S 蛋白首先会被标记了胶体金的抗体识别并结合,接着流到 T 线时,T 线处的捕获抗体 结合带标记的新冠抗原识别抗体出现可检测信号,即得到检测线为阳性结果,反之若样本为阴性, 检测线则为阴性结果。因此,当 C 线、T 线均显色才能代表检测结果为阳性。
该方法简单易行,可通过肉眼或者简易的仪器进行判断,全过程可在 15 min 内完成,且不需要专业 培训,非常适合于新冠抗原的快速检测。随着新冠特异性抗体筛选的进一步成熟,新冠抗原检测试 纸条的灵敏度和准确性以及与核酸检测的符合率都日益提高,从而逐渐成为新冠检测的主力产品。 目前,获得国家药品监督管理局批准上市的五款均采用免疫侧流层析法的原理。
基于免疫侧流层析法的抗 体检测的工作原理与抗原检测类似,区别在于其检测对象是 IgA、IgG 或 IgM。
2.2 化学发光免疫分析法
化学发光免疫分析法包含两个部分,即化学发光分析系统和免疫反应系统。化学发光分析系统是利 用化学发光物质经催化剂的催化和氧化剂的氧化形成一个激发态的中间体,当这种激发态中间体回 到稳定的基态时,同时发射出光子(hv),利用发光信号测量仪器测量光量子产额。免疫反应系统是将 发光物质(在反应剂激发下生成激发态中间体)直接标记在抗原或抗体上,或酶作用于发光底物。化学 检测系统通过光电信号检测仪检测发光强度,最后通过化学发光标记物与发光强度的关系确定被测 物的含量。根据标记物的不同可分为三大类,即直接化学发光免疫分析、酶促化学发光免疫分析和 电化学发光免疫分析。

3. 新冠抗原检测存在方式
世卫组织指出 COVID-19 控制的首要任务是部署可用的财务和人力资源,迅速识别有症状的个体或潜 在患者并隔离,从而实现高效防控。核酸、抗原和抗体检测方法各具特点,在不同的国家和不同的 使用场景下具有不同的应用,不能互相替代。将多种方法联合应用可提升检测效率,为各种可能的 风险人群提供双重保障,是防疫的关键。
核酸检测是确诊的首要标准。此类产品作为“金标准”在疫情初期最早被研发,新型冠状病毒肺炎诊疗 方案(第九版)提出,诊断需首先根据流行病学史﹑临床表现、实验室检查等进行综合分析﹐最后 是根据新型冠状病毒核酸检测结果确诊阳性患者。
抗体检测是辅助诊断的重要依据。试纸条上市后,因其检测时间仅有 15 min,迅速被各国大范围使 用,在医疗条件不足、发生挤兑的国家、地区,抗体检测成为了大规模初筛的手段。但是由于抗体 检测因存在检测窗口期,只能做既往感染判别,不适用于复阳患者和再次感染患者的检测等问题, 主要用于辅助诊断。此外,据新型冠状病毒肺炎诊疗方案(第九版),未接种新型冠状病毒疫苗者, 新型冠状病毒特异性抗体检测可作为诊断的参考依据。接种新型冠状病毒疫苗者和既往感染新型冠 状病毒者,原则上抗体不作为诊断依据。
抗原检测是早期筛查的有效手段。随着疫情的进一步恶化,包括欧美发达国家在内的检测能力都遭 遇到瓶颈,抗原 POCT 检测作为高效、便利的快检产品得到广泛的重视,尤其是随着新冠特异性抗 体研发的逐渐成熟,抗原检测的准确度获得了更多的认同。自 2020 年年中,快速抗原检测相关产品 以其成本更低、速度更快的优势亮相于市场,并且其中一些已被列入世卫组织紧急使用清单之中。 世卫组织建议,在疫情调查期间,可采用满足最低性能要求的快速抗原检测方法进行初级病例检测、 接触者追踪,监测社区疾病发病趋势等相关工作。
相对于核酸检测,抗原检测作为国内近期兴起的新冠病毒检测手段具有存在的必要性,特别是在拦 截阻击涉外疫情防控的“三大防线”方面具有重要作用。具体体现在:1)针对拦截入境染疫人员的第 一道防线,快速抗原检测可实现远端抗原(24 小时)和核酸双阴登记,口岸快速检测与现场拦截, 居家健康监测(核酸七天两检和抗原七天三检);2)针对拦截涉外暴露人员的第二道防线,快速抗 原检测可实现对涉外工作人员的健康监测;3)针对检测和拦截破防人员的第三道防线,快速抗原检 测可实现哨点监测预警加码快速抗原,重点场所和人员进行赋码通行。可见抗原检测将有效推进“加 快结果报告速率、加密检测频次、加码防控”的“三加”防控管理措施,对常态化疫情防控工作的落实, 防范境外疫情输入和境内疫情反弹等工作具有重大意义。
4. 病毒后续变异对抗原检测有效性的影响分析
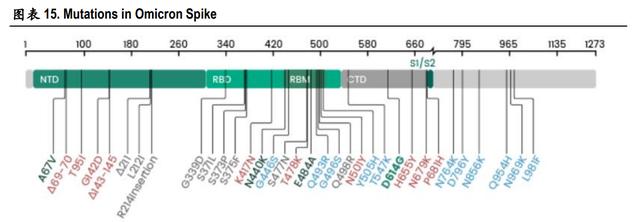
据《中国国境卫生检疫杂志》(新冠病毒抗原快速检测试剂的性能及其适用范围)信息,新冠病毒 病毒基因组全长 29891 个核苷酸 ,有 5 个必需基因,分别编码核蛋白(N)、病毒包膜(E)、基质 蛋白(M)和刺突蛋白(S)4 种结构蛋白及 RNA 依赖的 RNA 聚合酶(RdRp)。目前在全球创新诊断 基金会登记的大部分 Ag-RDT 试剂的检测靶标是新冠病毒的 N 和 S 蛋白,少部分可检测 S1 和 S2 亚基 蛋白、S 蛋白受体结合域。世卫组织指出,病毒基因组变异可能影响抗原快速检测的检测能力,原 因是靶蛋白构型或靶病毒丰度发生变化。WHO 正在监测关于诊断逃逸突变的报告,并在测序数据库 中跟踪其出现频率。
S 蛋白受体结合域的多个突变是主要的突变,以 S 蛋白作为靶点的抗原检测产品受病毒变异的影响 可能较大,因此国内获批新冠抗原自测产品在以 S 蛋白作为靶标时通常也要加入 N 蛋白同时作为检 测靶标,如诺唯赞、奥泰生物等抗原检测产品。在目前已经检测分离到的新冠突变株中,S 蛋白上 的突变位点最多最关键,Omicron(B.1.1.529)变异株是迄今为止出现的突变 最严重的变异株,其传染性比原始毒株高 500%,该变异株的基因组有大约 50 个突变,其中 S 蛋白 中的突变就有 30 多个,占到了一半以上。
N 蛋白高度保守,以 N 蛋白作为靶点的抗原检测产品受病毒变异影响小,新冠病毒的抗原检测一般 是把 N 蛋白作为目标抗原。SARS-CoV-2 N 蛋白全长 419 个 氨基酸,由 N 端结构域(NTD)和 C 端结构域(CTD)以及连接两个结构域及其两侧的三段无规则柔 性区(IDR)构成。这种 N 蛋白在病毒内的含量较高,相对病毒表面蛋白已知产生的突变较少,所以 选择 N 蛋白作为检测靶标可以提高检测灵敏度也可避免新病毒突变引起的漏检。
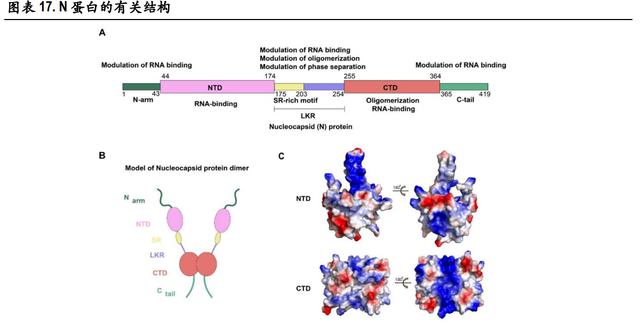
目前已经上市的新冠抗原检测试剂是否可以检测到突变后的 N 蛋白以及检测灵敏度和特异性是否会 受到突变的影响需要进一步的研究。虽然 N 蛋白相对于 S、M 蛋白更为保守,突变频率虽然不高, 但因为新冠病毒在全球范围内的快速传播,流行突变株中的 N 蛋白上已经出现了特征性突变位点, 其中位于 LINK 上的 R203K/G204R 是最常见的高频突变。此外,备受关注的N 突变还包括常见于南非 突变株的 T205l,巴西突变株的 P80R,英国突变株的 D3L/S235F,印度突变株的 D63G/R203M/D377Y/R385K 等等。
作为新冠抗原检测的主要靶标,N 蛋白上发生的突变是否会影响抗原检测试剂盒的灵敏度还 有待评估。面对全球不断出现的变异毒株,已经上市或仍在研发的抗原检测试剂盒需要对主流变异 毒株的 N 蛋白进行测试,来确保试剂盒的灵敏度和准确性不受到影响。总之,病毒后续变异对抗原检测有效性的影响还存在不确定性,相对应的风险也值得关注。(报告来源:未来智库)

截至 2022 年 3 月 24 日,国内共计 19 款新冠抗原检测试剂获批上市,主流技术原理为胶体金免疫层 析法,包括 14 款胶体金免疫层析法,2 款乳胶法,3 款荧光免疫层析法,其中 3 款以荧光免疫层析法 为原理的检测试剂需要配套仪器使用,其余 16 款适用于居家检测场景。
1.上游:新冠特异性抗体是抗原检测试剂的核心原料
免疫层析法采用高度特异性的抗原抗体反应及免疫层析技术,试剂含有预先固定于 NC 膜上检测区的 抗原/抗体和包被在标记垫上的抗原/抗体彩色标记物。
检测时,将待测样本滴入试剂加样区,待测样本与标记垫上的抗原/抗体彩色标记物反应。随后,混 合物在毛细效应下向上层析。如果样本是阳性,抗原/抗体彩色标记物先与样本中的特异性抗体/抗原 结合,形成抗原-抗体混合物或者 抗体-抗原混合物。随后该抗原-抗体混合物或抗体-抗原混合物会被 固定在膜上的抗原/抗体捕捉,从而在检测线(T)出现一条有色条带。如果样本是阴性,检测线(T) 不会出现有色条带。而无论样本是阳性还是阴性,质控线(C)处都会出现一条有色条带,其出现与 否是判定样本数量是否充足、层析过程是否正常的标准。
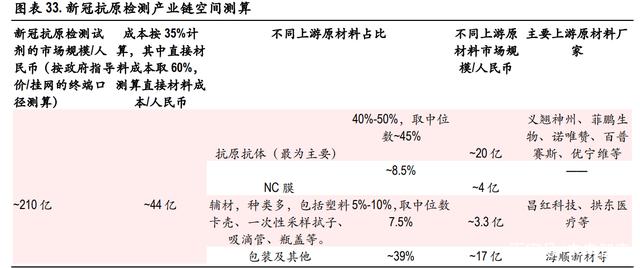
根据东方生物招股说明书,新冠抗原检测试剂原材料分为主材和包材两大类,其中主材又可以分为 抗原抗体、主要材料和辅助材料,主要材料包含硝酸纤维素膜(NC 膜)、PVC 胶板等,辅助材料种 类与数量较多,耗用最大的是塑料卡壳,包材主要是铝箔袋、纸盒等。对新冠抗原检测试剂涉 及的原材料生产商进行了梳理。
新冠抗原检测中,抗原与抗体一一对应的特异性关系决定了其互为免疫诊断的检测物与被检测物, 特异性结合的效果甚至结合的成功与否,是影响免疫诊断试剂临床检测表现的关键。因此,抗体性 能与质量的优劣对抗原诊断试剂的灵敏度、特异性等指标乃至诊断试剂的整体性能与质量优劣有很 大影响。新冠病毒特异性抗体是抗原检测试剂的核心原材料,对新冠抗原检测试剂生产企业的 抗体自产情况进行了梳理。
2.终端渠道:线上线下双管齐下
渠道铺设方面,新冠抗原国内试剂获批后,线上购药平台和线下连锁药房都迅速做出反应。美团买 药、阿里健康、京东健康纷纷上线预售通道,叮当快药与热景生物展开合作;与此同时,线下渠道 也开始了行动。老百姓、益丰大药房、一心堂、高济药房等纷纷与相关厂家签订协议,诺唯赞获取 上药医疗器械超大订单;1 药网与万孚生物、博奥赛斯、华大基因展开合作;九州通与华大基因、华 科泰达成战略协议;合纵药易购也与热景生物、明道捷测相继签约。乐普生物在公司旗下电商平台 护生堂大药房展开预订,并在旗下互联网医疗 APP 上进行相关推广。
这一系列事件对于 POCT 线上和线下的渠道建设,提升消费者对 POCT 的产品认知都有着积极作用。 价格方面,美团、阿里健康等电商平台上,新冠抗原试剂的标价在 20 元/人份到 30 元/人份之间,线 下平台的标价普遍在 10 元/人份到 30 元/人份之间。

2021 年 3 月 11 日,国家卫健委发布消息,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组决 定在核酸检测基础上,增加抗原检测作为补充,并组织制定了《新冠病毒抗原检测应用方案(试行)》。 《方案》中明确了抗原检测的适用人群,及不同人群进行抗原检测需满足的主要条件、检测试剂的 获得渠道等。该《方案》的出台确定了抗原检测的重要战略地位。
截至 2022 年 3 月 24 日,我国 NMPA 批准了包括万孚生物、华大因源、诺唯赞、北京金沃夫生物和北 京华科泰等公司的 19 款新冠抗原自检类试剂盒。当然事实上我国部分公司的抗原检测产品已率先在 欧洲或美国得到批准并市场销售。整体而言欧洲市场用于家用抗原检测试剂产品较多、竞争更为激 烈。美国市场方面因 FDA 对家用新冠抗原检测试剂盒的审批较为严格,目前我国企业中如:艾康生 物、九安医疗和东方生物(为西门子的代工商)拿到了美国的 EUA。
中国国内市场方面新冠抗原检测自检类试剂盒批准时间晚于欧美国等地区。但考虑到中国国内人口 基数大带来的抗原检测潜在需求,预计已经拿到 CE 认证和美国 EUA 证的公司也会加速在国内进行 注册申请。国内抗原检测市场竞争或将更为激烈。
关于我国新型冠状病毒抗原检测试剂的审批
3 月 14 日,国家药监局发布了《新型冠状病毒抗原检测试剂注册技术审评要点(试行)》,该审评 要点(试行)旨在指导注册申请人对新型冠状病毒(2019-nCoV)抗原检测试剂的产品设计开发及验 证确认过程,并指导注册申请人对该类试剂注册申报资料的准备及撰写,同时也为技术审评部门对 注册申报资料的技术审评提供参考。
该审评要点有三点内容值得关注,第一,对样本量的数量和类别设臵了要求。审评要点建议对比试 剂(核酸检测试剂)检测阳性样本不少于 200 例,阴性样本不少于 300 例,并且还对阳性样本的的病 毒载量做出了要求,建议阳性样本中 Ct 值≤30 的阳性样本例数不低于 170 例,Ct 值>30 的阳性样本 例数不低于 30 例。同时,在非专业使用者与专业人员检测对比试验中,建议纳入至少 70 例抗原阳 性受试者,70 例抗原阴性受试者,其中应包括至少 10 例阳性受试者在检测之前尚未确认新型冠状病 毒感染,在临床试验过程中检出感染阳性状态。该规定的颁布为后续审批的检测试剂设臵了准入门 槛,或许是新冠抗原检测试剂上市速度放缓的原因之一。

第二,对外购抗体和自制抗体有不同的审批要求。自制抗体需要应提交详细的研究资料和工艺稳定 性验证资料,外购的抗体提交供应商选择的研究资料及供应商出具的抗体性能指标及检验报告。因 此,目前能够出具抗体性能指标及检验报告的上游生产商或将因此获益。
第三,关于境外临床试验数据,该审评要点要求提供境外临床数据适用于中国患者人群的论证资料、 境内外临床试验质量管理差异的对比资料和临床试验质量管理差异对于临床试验结果影响的论证资 料。有关可用性评价和结果判读能力评价应在境内完成。所以,已在境外上市产品的海外临床数据 是不完全被认可的,需要论证其境内临床试验数据的充分性。
我们认为国家对新型冠状病毒抗原检测试剂的审批会趋严,虽然不排除陆续还会有其他公司相关产 品获批的可能,但是审批速度已明显趋缓。相信未来产品质量更优、性价比更高、渠道推广做的更 好的公司会在竞争激烈的市场中赢得更大的市场份额。
关于新型冠状病毒抗原检测试剂的价格
3 月 21 日,国家医保局印发《关于切实做好当前疫情防控医疗保障工作的通知》(下称《通知》), 明确各省级医保部门要按程序将新冠病毒抗原检测试剂及相应检测项目临时性纳入本省份基本医保 医疗服务项目目录,参保人在定点基层医疗机构发生的相关费用按统筹地区现行规定支付,在定点 零售药店购买检测试剂的费用,可使用个人账户支付。而在 3 月 22 日发布《国家医疗保障局办公室 关于地方拟临时新增新型冠状病毒抗原检测项目及有关事项意见的函》,对河南省、重庆市医保局 临时新增新型冠状病毒抗原检测项目及相关收费标准表示同意。截至 3 月 21 日,包括天津、云南、 河南、重庆、河北、吉林等在内的多省份已经明确新冠抗原检测价格管理政策。
根据新冠抗原检测试剂在津冀、鲁晋、甘肃三地的挂网价格,新冠抗原检测试剂盒的挂网价格在 7.9 元-9.8 元区间,均值为 8.96 元。
3 月 15 日,鲁晋联盟迅速开展开展新冠病毒抗原检测试剂产品专项集中采购工作,3 月 16 日公布中 选结果,其中最低中选价格为华大基因(7.9 元/人份),最高价为博奥塞斯(9 元/人份)。
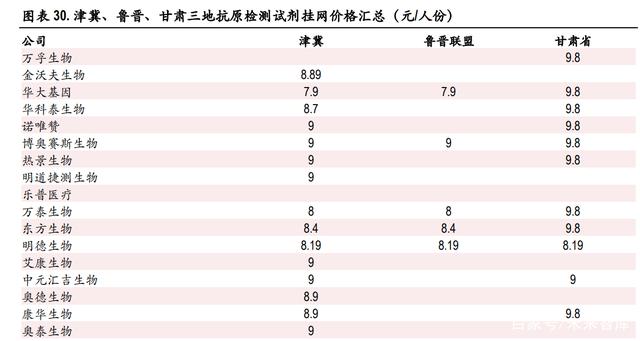
3 月 18 日,津冀地区开展新型冠状病毒抗原检测试剂挂网采购工作,并于 3 月 21 日公示津冀新型冠 状病毒抗原检测试剂挂网采购价格信息(第一批),共 15 家企业中标,挂网价格最低为华大基因(7.9 元/人份),最高为 9 元/人份。
3 月 22 日,甘肃省新型冠状病毒抗原检测试剂阳光挂网结果公示,共 12 家企业中标,其中最低价为 明德生物(8.19 元/人份),最高价为 9.8 元/人份。
市场空间预测
市场规模预测存在一定的不确定性,需理性看待新冠抗原自测产品市场空间,而且该市场空间很大 程度上取决于国家防控政策、集采政策、医保控费政策等。
根据《新冠病毒抗原检测应用方案(试行)》,将新冠抗原检测需求端细分为:①到基础医疗卫生 机构就诊,不具备核酸检测能力的人群;②隔离观察人员,包括居家隔离观察、密接和次密接、入 境隔离观察、封控区和管控区内人员;③有抗原自我检测需求的社区居民。其中有自我检测需求人 群又进一步细分为:1)出差、旅游等跨省市流动人员;2)口岸检疫、边检等口岸城市高风险岗位人群; 3)定点医院医护工作人员;4)农集贸市场、交通运输、快递物流、进口冷链食品等从业人员。参考国 务院印发《新冠病毒抗原检测应用方案(试行)》中的①②类人群每月使用频次 5 次,并保守假设 有 20%的③类人群选择每月抗原自测 1 次,按重庆市医疗保障局发布的政府指导价 5 元/人份预测, 单月市场空间约 7 亿元,年市场规模约 84 亿元;按津冀挂网采购最低价 7.9 元/人份预测,单月市场 空间约 11 亿元,年市场规模约 132.9 亿元。市场空间乐观估计假设有 50%的③类人群选择每月抗原 自测 1 次,按重庆市医疗保障局发布的政府指导价 5 元/人份预测,单月市场空间约 17.5 亿元,年市 场规模约 210 亿元;按津冀挂网采购最低价 7.9 元/人份预测,单月市场空间约 27.58 亿元,年市场规 模约 332 亿元。在此我们取保守估计(年市场规模约 84 亿元)与乐观估计(年市场规模约 332 亿元) 平均值测算新冠抗原检测试剂年市场规模(按政府指导价/挂网的终端口径测算)约为 210 亿元。
同时,海外疫情持续蔓延,德英美等国家相继实施新冠病毒快速检测计划,致使海外新冠抗原自测 需求强烈。反观国内,核酸检测能力较强,并将抗原自测定位为核酸检测的补充,国家药监局虽已 批准了 19 款新冠病毒抗原检测试剂产品(截至 3 月 24 日)。国家防控政策为抗原自测市场的总阀门, 需理性看待国内抗原检测产品未来的市场空间。
零售平台与医药电商方面的零售价格预计会比终端价高出一部分,不同地区不会有较大差异。政府 推广新冠抗原检测的节奏较为谨慎,若政策逐步放开,短期内可能会有一个抗原检测的过渡阶段, 长期来看,随着疫情防控常态化,检测需求也将呈现常态化趋势,未来相关检测试剂的价格或将回 落,但考虑国内人口基数大,国内抗原检测市场空间仍然可期。另外,我国类似于九安医疗、东方 生物等很大一部分企业试剂已经走向海外,海外市场同样值得关注。
同时,我们对新冠抗原检测产业链各环节空间也给了空间测算。
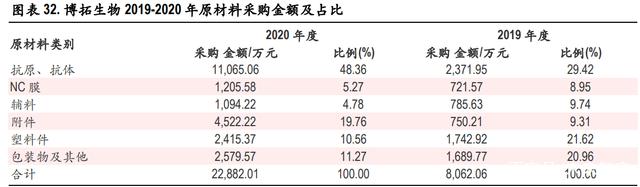
根据博拓生物招股说明书显示,公司 2020 年新冠检测营收主要来自海外的抗原检测,新冠检测收入 占到总收入 70%以上,原材料几乎全部外购,因此我们取博拓生物 2020 年的成本拆分来大概测算抗 原检测上游成本占比。我们按抗原自测上游成本占比为抗原抗体约 45%, NC膜约 8.5%,辅材约占 7.5%, 包装等其他材料约占 40%进行测算。
1. 中短期来看新冠抗原检测事件或将带来相关的整个产业链布局机会
从上游抗原生产商,到终端试剂盒生产厂家再到销售渠道都或将迎来利好。
2. 中长期来看,新冠抗原检测方案的试行叠加我国一直以来的分级诊疗政策 POCT 迎来发展新机遇
POCT 是体外诊断的一个分支,指通过便携试剂和仪器在病人身旁进行的临床检测及床边检测,在采 样现场即进行样本分析的诊断方法。其优点在于诊断时间更短,占用病人以及医护人员更少的检验 时间,相较于传统的检验流程更为快速便捷,同时 POCT 能够在快速取得检测结果的同时免去了样 本的处理和数据分析等繁琐的步骤,也不必再依赖于专业人员的操作,有助于降低医院医疗资源的 占用。目前,POCT 凭借其独特优点,已成为体外诊断行业内发展最快的细分领域之一。
2020 年的新冠疫情爆发以来,POCT 在出入境、机场、火车站、基层医疗单位等场景得以广泛应用, 操作的简易性节约了医疗资源、提高了检测效率,在疫情防控方面发挥了重要作用。POCT 实现了“去 实验室中心化”,这次新冠抗原自测产品试行方案的推行,或将进一步驱动诊断场景逐渐从中心实验 室向基层甚至 C 端渗透,即时、简便、不受地点限制使用的 POCT 或将迎来新的发展契机。
新冠检测业务是一次国民背景知识的科普,同时也是国产 POCT 龙头打开海外市场的良机,长期来 看 POCT 行业龙头或将趁这次机会增强市场认知,同时随着我国分级诊疗制度、DIP/Drgs 政策推行进 一步打开常规非新冠检测推广渠道,进一步打开增量市场,拓展海内外发展空间。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地址:zhanya2011@126.com
CEIVD 2022上海国际检验医学仪器及IVD体外诊断试剂展览会定于2022年6月29-7月1日在上海世博展览馆举办,会主要来自全国的医院、经销商、代理商、渠道商、进出口贸易商、临检中心、独立检验实验室、妇幼保健院、疾病控制预防中心、血站、血液中心和出入境检验检疫局等部门的采购负责人、主任、教授、医生以及专家、学者汇聚展会现场进行交易、合作、交流; 随着展会面积扩大、参展企业增多以及观众数量的逐年上升,为了充分展示临床检验医学产品,加强技术交流与合作,推动我国临床检验仪器及体外诊断试剂行业快速发展,2022上海国际检验医学及体外诊断试剂展览会”定于6月29日—7月1日在上海世博展览馆隆重举行 。 组织单位以“为人类健康作出正确的诊断、为更好的明天而努力”为宗旨,展会坚持走专业化的特色发展道路,以推动产业升级、行业创新发展为己任,为国内外买家采购交流提供一个医疗行业的饕餮盛宴!参展咨询热线:18930529086(微信同号)
www.chinajyexpo.com/shanghai上海展
